Inhalt
Kapitel 1 Zellteilung
Warum beginnt man einen Text zur Allgemeinen Histologie mit dem Thema Zellteilung? Dafür gibt es mindestens zwei gute Gründe: Zum einen bestehen die menschlichen Gewebe und Organe aus etwa 1014 Zellen, die in über 200 verschiedene Zelltypen differenziert sind. Diese Vielzahl und Vielfalt an Zellen hat ihren Ursprung in einer befruchteten Eizelle. Das bedeutet, dass die Ausprägung von Geweben und Organen notwendig an Zellteilungen gebunden ist. Da das Verständnis der meisten Gewebe voraussetzt, dass man ihre Entstehung (Histogenese) kennt, ist eine grundsätzliche Vorstellung über Zellteilung notwendig. Zum anderen haben Zellen innerhalb eines Gewebes oft nur eine begrenzte Lebensdauer und müssen kontinuierlich ersetzt werden (Regeneration). Auch hierbei sind Zellteilungen notwendig, die sich direkt oder indirekt histologisch fassen lassen.
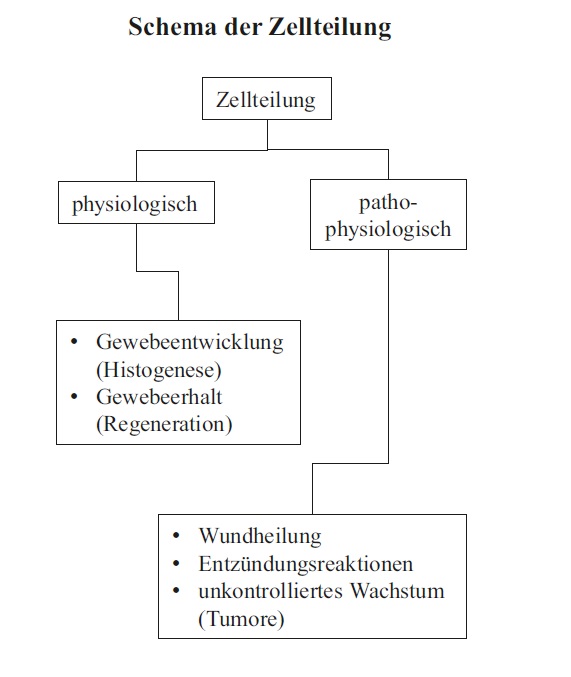
Blickt man über diese physiologischen Gegebenheiten hinaus, so stehen auch pathophysiologische Vorgänge wie die Geweberegeneration nach Verletzungen (Wundheilung) oder die unkontrollierte Vermehrung von Zellen in Tumoren eng mit der Zellteilung in Verbindung. Darüber hinaus können Abwandlungen der normalen Zellteilung zu mehrkernigen Zellen oder zu sogenannten polyploiden Zellen führen, die mehr als den diploiden Chromosomensatz (s. u.) enthalten.
Um die Zellteilung und ihre Varianten zu verstehen, ist es nützlich, sie in drei Teilprozesse zu zerlegen:
• die Teilung des Zellkerns (Karyokinese)
• die Teilung des Centrosoms
• die Teilung des Zellkörpers (Cytokinese)
Zeitlich greifen diese drei Prozesse ineinander und hängen entsprechend voneinander ab.
Kapitel 2 Epithelgewebe
Ein anderer Begriff für „Epithelgewebe“ ist „Deckgewebe“ und dieser Begriff beschreibt, was Epithelien meistens tun: Sie bedecken äußere und innere Oberflächen. Die Haut, als prominenteste äußere Oberfläche, ist im wahrsten Sinne des Wortes das greifbarste Beispiel, aber auch innere Oberflächen sind leicht vorstellbar, wie die Oberfläche der Lungenbläschen (Alveolen) oder die Innenwände der Gefäße. Nur wenige Oberflächen besitzen keinen epithelialen Überzug, wie die Seite der Iris, die zur vorderen Augenkammer zeigt.
Aus welchen Zellen können sich Epithelzellen während der Embryogenese bilden? Verfolgt man die Entwicklung eines Säugerembryos zurück bis zum Ende der Gastrulation, trifft man auf die drei sogenannten Keimblätter – Ektoderm, Mesoderm
und Endoderm –, aus denen sich der Embryo entwickelt (Abb. 2.1). Nehmen wir die drei oben genannten Beispiele und verfolgen deren Entwicklung zurück bis zu den Keimblättern, so entstammt die Haut dem Ektoderm, das Gefäßepithel dem Mesoderm und das Alveolarepithel dem Endoderm. Alle drei Keimblätter können also epitheliale Strukturen hervorbringen.
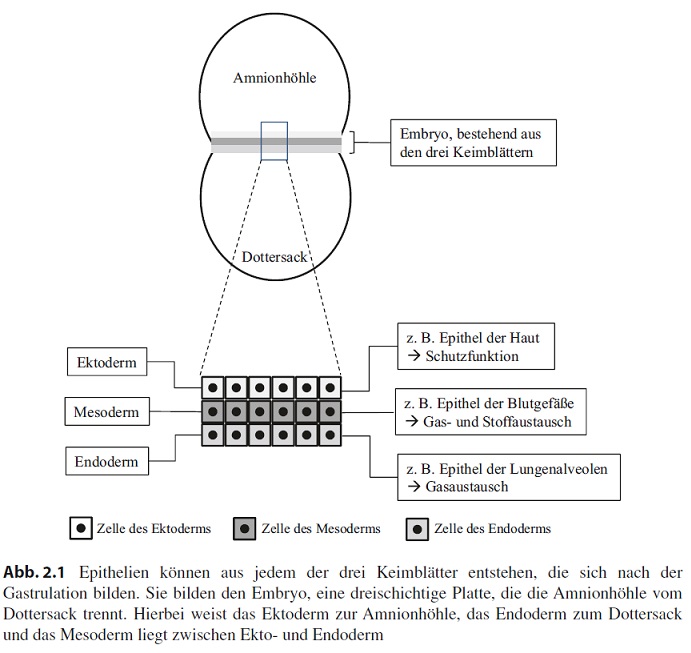
Mit Epithelien sind verschiedene Funktionen verknüpft. Betrachten wir noch mal die drei Beispiele, so ist das Epithel der Haut in vielfältiger Weise an unterschiedlichen Schutzfunktionen beteiligt, in den Alveolen findet Gasaustausch statt und in den kleinsten Gefäßen, den Kapillaren, gibt es einen Gas- und Stoffaustausch. Alle genannten Funktionen sind abhängig von den Epithelzellen und tatsächlich werden in vielen Organen die organspezifischen Funktionen von epithelialen Zellen geleistet.
Um uns dem Epithel zu nähern, stellen wir uns eine einfache Deckzellschicht vor, die nur aus einer Lage Zellen besteht, deren Höhe im Längsschnitt größer ist als ihre Breite (Abb. 2.2).
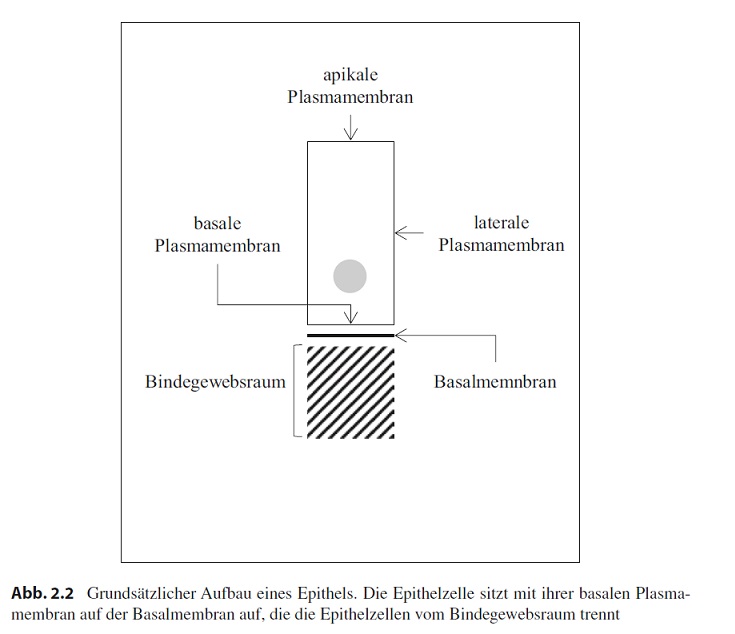
[Hinweis: In der Abb. 2.2 steht Basalmemnbran. Richtig ist Basalmembran]
Die Plasmamembran dieser Zelle bildet die eigentliche Oberfläche (apikale Membran), berührt die Plasmamembranen benachbarter Zellen (laterale Membran) oder steht in Kontakt mit dem darunter liegenden Gewebe (basale Membran). Die basale Membran sitzt einer speziellen Schicht auf, die bei fast allen Epithelien gefunden und Basalmembran genannt wird. Unter der Basalmembran beginnt der Bindegewebsraum.
Die histologische Unterscheidung verschiedener Epithelien beruht auf der unterschiedlichen Komposition der Epithelzellschicht, die der Struktur eines Epithels das charakteristische Erscheinungsbild verleiht.
Kapitel 3 Binde- und Stützgewebe
In diesem Teil der Allgemeinen Histologie werden mehrere Gewebearten besprochen, von denen sich nahezu alle aus dem Mesoderm entwickeln. Ein Beispiel für eine Ausnahme von dieser Regel ist der Bindegewebsraum der Zahnpapille, dessen Zellen aus der Neuralleiste (Abschn. 5.1) stammen und somit neuroektodermaler Herkunft sind.
Eng verwoben mit dem Bindegewebe ist das Fettgewebe in seinen verschiedenen Erscheinungsformen. Obwohl beide Gewebe sehr unterschiedliche Funktionen haben, bilden sie da, wo Fettgewebe vorkommt, strukturell eine Einheit. Ursprünglich wurde dem Bindegewebe die Funktion eines schlichten Gerüsts zugesprochen, in dem epitheliale Zellen verankert sind und so im Verband stabilisiert und zusammengehalten werden. Dieses rein mechanische Bild des Bindegewebes ist schon lange nicht mehr haltbar, denn biochemische und zellbiologische Untersuchungen der letzten Jahrzehnte haben gezeigt, dass der Bindegewebsraum selbst funktionell und strukturell äußerst komplex ist und darüber hinaus auf vielfältige Weise mit den assoziierten epithelialen Strukturen in Wechselwirkung tritt.
Das eigentliche Stützgewebe der Vertebraten ist das Knochengewebe, aus dem die Knochen des Innenskeletts gebildet werden. Diese dynamische Hartsubstanz ist erstaunlich anpassungs- und regenerationsfähig. Sie entsteht durch Einlagerung von Calciumphosphatsalzen in eine Matrix, die im Wesentlichen einem herkömmlichen Bindegewebe entspricht. Funktionell ist das Knorpelgewebe zwischen Knochen- und Bindegewebe angesiedelt, das aufgrund seiner Struktur besondere mechanische Eigenschaften besitzt und deshalb auch eher als Stützgewebe aufgefasst werden muss.
Kapitel 4 Muskelgewebe
Muskelgewebe ist die Grundlage für die Bewegung eines Organismus als Ganzes (Skelettmuskulatur) oder aber von Teilstrukturen (Herzmuskulatur, Organmuskulatur). Diese drei Muskeltypen untergliedert man nach ihrem histologischen Erscheinungsbild in die quer gestreifte Muskulatur (Skelett- und Herzmuskulatur) und die glatte Muskulatur (Organmuskulatur). Eine Zusammenfassung der wichtigsten Merkmale zeigt Tab. 4.1.
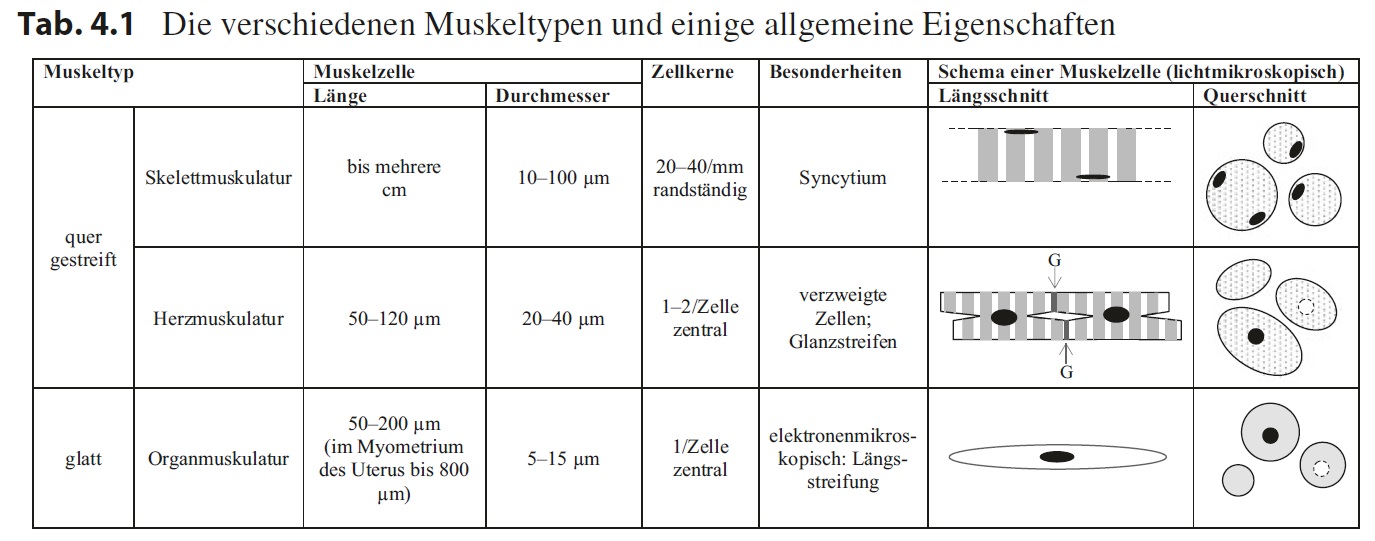
Die Zellen der quer gestreiften Skelettmuskulatur sind bis einige Zentimeter lange Strukturen mit einem über ihre Länge gleichbleibendem Durchmesser, der mit 10–100 μm zum Teil überdurchschnittlich groß ist. Der Querschnitt der Zellen ist
im Wesentlichen rund und man erkennt bei guter Fixierung ein Muster von kleinen Punkten. Im Längsschnitt ist in der hohen Vergrößerung ein regelmäßiges Hell-Dunkel- Muster, das senkrecht zur Plasmamembran verläuft, zu sehen – die sogenannte Querstreifung.
Jede quer gestreifte Skelettmuskelzelle enthält eine Vielzahl von Kernen (20–40 pro mm), die alle randständig, also direkt unter der Plasmamembran, liegen. Die Zellen entstehen embryonal aus Myoblasten, die miteinander zu mehrkernigen Riesenzellen fusionieren, welche man in der adulten Muskulatur beobachtet. Die quer gestreifte Skelettmuskelzelle ist also ein Syncytium.
Die quer gestreifte Herzmuskelzelle ist relativ kurz (50–120 μm) und verzweigt, sodass sich jede einzelne Zelle an ihren Enden mit mehreren Zellen verbinden kann, um so ein zelluläres Netzwerk zu bilden. Die Stellen, an denen zwei Herzmuskelzellen miteinander verbunden sind, zeigen in den meisten Färbungen dichte Linien, die sogenannten Glanzstreifen, die sich deutlich von der übrigen Querstreifung der Zellen abhebt, wobei die Querstreifung der Herzmuskelzellen aussieht wie die der Skelettmuskulatur.
Die Zellen enthalten in der Regel einen, selten zwei Zellkerne, die in der Zellmitte liegen. Der Durchmesser der Zellen ist moderat (20–40 μm) und im Querschnitt sieht man ebenfalls ein Punktmuster, eventuell mit einem angeschnittenen,
mittigen Zellkern oder einem ebenfalls mittig liegenden, aber nicht gepunkteten Areal.
Die Form des Querschnitts ist vielgestaltig. Die glatte Muskelzelle ist eine schlanke, spindelförmige Zelle, die in der Regel eine Länge von 50–200 μm hat sowie, an der dicksten Stelle, einen Durchmesser von 5–15 μm. Hier liegt meist auch der einzige Zellkern, den die Zelle besitzt. Selbst bei hoher Vergrößerung ist keine Querstreifung zu erkennen, aber elektronenmikroskopisch sieht man eine aus dünnen Fasern bestehende Längsstreifung. Der Durchmesser der Querschnitte an verschiedenen Stellen der glatten Muskelzelle variieren entsprechend ihrer spindeligen Form, wobei mittig ebenfalls der Kern oder eine Aufhellung des Cytoplasmas zu sehen sein kann.
Im Folgenden werden zunächst ausführlich Bau und Funktion der Skelettmuskulatur dargestellt, um dann die Herz- und Organmuskulatur in Anlehnung an die Skelettmuskulatur zu beschreiben.
Kapitel 5 Nervengewebe
In der Embryonalentwicklung entstehen im Zuge der Gastrulation drei übereinanderliegende Zellschichten, das Ektoderm, das Mesoderm und das Endoderm (Abb. 5.1). Im Mesoderm entwickelt sich medial eine stabförmige Struktur, die sogenannte Chorda dorsalis (auch als Notochord bezeichnet). Die Chorda dorsalis ist phylogenetisch das ursprünglichste Achsenskelett und hat dem Tierstamm der Chordata den Namen gegeben. Neben ihrer Bedeutung als Skelettstruktur induziert sie im Ektoderm die Anlagen, aus denen sich das Nervensystem entwickelt. Dieser Vorgang wird als Neurulation bezeichnet. Zunächst verdickt sich das über der Chorda dorsalis gelegene Ektoderm zur sogenannten Neuralplatte. Diese senkt sich anschließend ab und bildet die Neuralrinne. Die Neuralrinne schließt sich zum Neuralrohr, das sich dabei vom
Ektoderm trennt und dann als neuroektodermale Struktur im Mesoderm liegt (Abb. 5.1).
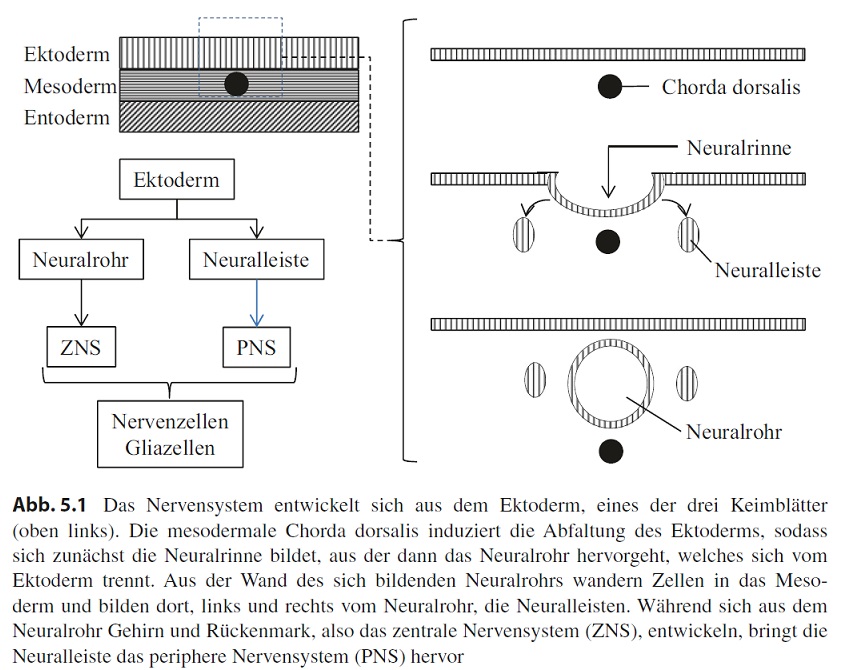
Die Ausbildung des Neuralrohrs findet nicht auf der ganzen Länge gleichzeitig statt, sondern beginnt im mittleren Bereich und setzt sich nach cranial und caudal fort. Verschlussdefekte führen im caudalen Bereich zum Krankheitsbild der sogenannten Spina bifida, im cranialen Bereich zu Störungen der Liquorzirkulation bis hin zur Ausbildung eines Hydrocephalus. Im cranialen Bereich bildet das Neuralrohr Bläschen, die komplex gefaltet werden und die Anlage für das Gehirn darstellen, während aus dem mittleren und caudalen Bereich des Neuralrohrs das Rückenmark entsteht. Gehirn und Rückenmark bilden zusammen das Zentralnervensystem (ZNS).
Lateral differenzieren sich im Neuroektoderm Zellen, die im Zuge der Neurulation das Neuralrohr verlassen und im Mesoderm die sogenannte Neuralleiste bilden. Zellen dieser Struktur weisen während der weiteren Embryonalentwicklung eine hohe Mobilität auf und tragen am Ende zur Entstehung unterschiedlichster Gewebe und Organe bei. Beispiele für solche Zellen und die jeweiligen Gewebe bzw. Organe sind die Odontoblasten (Zahn), calcitoninproduzierende Zellen (Schilddrüse), chromaffine Zellen (Nebennierenmark) und Pigmentzellen (Haut). Darüber hinaus entwickelt sich aus der Neuralleiste das periphere Nervensystem (PNS), das zusammen mit dem ZNS das Nervensystem bildet.
ZNS und PNS bestehen im Wesentlichen jeweils aus zwei Zelltypen: Nervenzellen (Neurone) und Gliazellen. Die wesentliche Aufgabe der Neurone ist die Aufnahme, Verarbeitung und Weiterleitung von elektrischen Signalen, wobei eine intensive Kommunikation zwischen dem PNS und ZNS stattfindet. Neurone sind entweder untereinander verschaltet oder sie nehmen Reize über spezifische Sinneszellen auf bzw. übertragen Impulse auf nichtneuronale Zellen wie z. B. Muskelzellen oder Drüsenzellen. Gliazellen schützen neuronale Zellen und unterstützen sie auf unterschiedliche Weise in ihrer Funktion.
Kapitel 6 Blut und Blutgefäße
Blut ist praktisch ein „mobiles Organ“, das sich im Gefäßsystem bewegt, und blutführende Gefäße finden sich, bis auf wenige Ausnahmen (z. B. Knorpel), in jedem Gewebe bzw. in jedem Organ. Gerade dieses universelle Vorkommen gibt dem Thema „Blut und Gefäße“ eine gewisse Berechtigung, mit den Themen der Allgemeinen Histologie zusammen dargestellt zu werden.
Blut ist im Prinzip eine sehr komplexe Zellsuspension – es besteht aus einer flüssigen Komponente und zellulären Bestandteilen. Entnimmt man Blut und lässt es unbehandelt stehen, setzt nach kurzer Zeit die Blutgerinnung ein, bei der am Ende ein Netzwerk aus dem Protein Fibrin entsteht, das sich aus der flüssigen Phase abscheidet. Zentrifugiert man anschließend, setzen sich die zellulären Bestandteile unten ab, darüber steht die flüssige Phase, eine komplexe Proteinlösung, die man Blutserum nennt und der nur die Proteine fehlen, die bei der Gerinnung abgeschieden wurden (Abb. 6.1). In der Regel
verhindert man aber die Gerinnung, z. B. durch Zugabe des Calciumchelators Ethylendiamintetraessigsäure (EDTA) oder von Natriumcitrat. In diesem Fall bezeichnet man die Flüssigkeit nach Abtrennen der Zellen als Blutplasma.
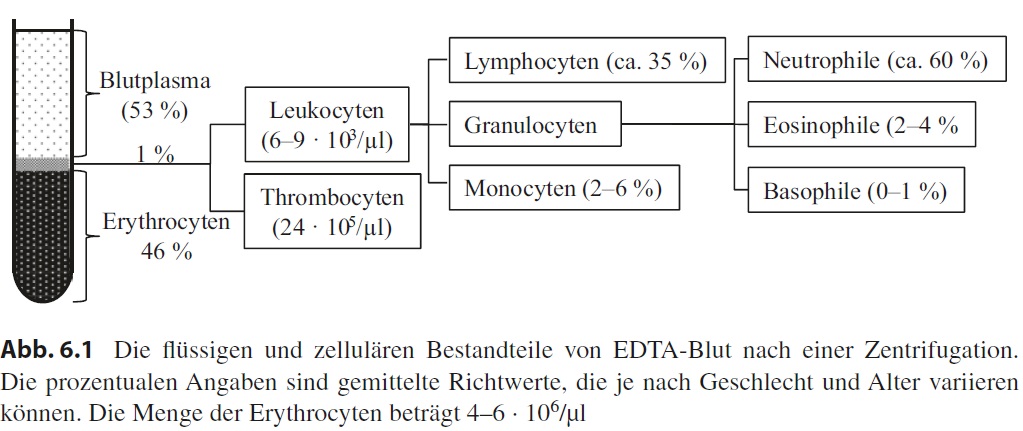
Während sich die Biochemie mit dem Blutplasma befasst, sind für die Histologie die zellulären Bestandteile des Bluts interessant. Ursprünglich führte man eine Zentrifugation durch, wie oben beschrieben, und erhielt eine Zellsäule mit darüberstehendem Blutplasma. Über die Gesamthöhe und die Höhe der Zellsäule kann man den sogenannten Hämatokrit errechnen, der den prozentualen Volumenanteil der Blutzellen angibt (Normalwerte für Personen ab 16 Jahre: ♀ 37–44 %, ♂ 40–50 %). Heute ermittelt man das mittlere Zellvolumen und die Anzahl der Erythrocyten (rote Blutkörperchen) und errechnet den Hämatokrit aus diesen beiden Werten. Da die Erythrocyten unter normalen Umständen gut 99 % aller Blutzellen ausmachen, können die anderen Zellen für diese Berechnung vernachlässigt werden.
Kehren wir noch einmal zur Zentrifugation zurück. Man beobachtet auf der Säule aus Erythrocyten eine sehr dünne, weißliche Schicht, die das restliche 1 % der zellulären Bestandteile repräsentiert. Obwohl der relative Anteil dieser zellulären Bestandteile gering ist, verbirgt sich hinter den sogenannten Leukocyten (weiße Blutzellen) eine Vielfalt verschiedener Zelltypen. Den größten Anteil mit ca. 60 % machen beim Menschen die neutrophilen Granulocyten aus, es folgen die B- und T-Lymphocyten (35 %), die Monocyten (2–6 %), die eosinophilen Granulocyten (2–4 %) und die basophilen Granulocyten (0–1 %). Schließlich gibt es noch die Thrombocyten, bei denen es sich aber nur um kleine, kernlose Zellfragmente handelt. Alle Blutzellen werden beim adulten Menschen im Knochenmark gebildet (Hämatopoese). Die prozentuale Zusammensetzung
der Leukocyten wird als Differenzialblutbild bezeichnet.
Die Gefäße bilden ein komplexes Röhrensystem, in dem das Blut in Form eines bzw. zweier Kreisläufe zirkuliert: im Körperkreislauf und im Lungenkreislauf. Zentrales Organ in diesen Kreisläufen ist das Herz. Für unsere Zwecke reicht es, wenn wir nur den Körperkreislauf betrachten, um zu sehen, welche verschiedenen Gefäßabschnitte es gibt. Nimmt man das Herz als Ausgangspunkt (Abb. 6.6), kommt man in die Arterien und hier zunächst in die Arterien vom elastischen Typ. Diese gehen über in die Arterien von muskulären Typ, gefolgt von den Arteriolen. Im nun folgenden Kapillarsystem erfolgt der Übergang vom arteriellen Teil in den venösen Teil. Der erste Abschnitt hinter den Kapillaren sind die Venolen, die übergehen in kleine Venen. Diese werden zum Herz hin, wo sich der Kreislauf schließt, immer größer. Sowohl das arterielle als auch das venöse System weist viele Verzweigungsebenen auf. Dabei wird in Flussrichtung des Bluts der Durchmesser jedes einzelnen Gefäßes im arteriellen System in der Regel kleiner und im venösen System größer. Aufgrund der Pumpleistung des Herzes herrscht im arteriellen System ein Druck von etwa 1,3–1,9 ∙ 104 Pa, weshalb man hier von einem Hochdrucksystem spricht. Hinter dem Kapillarbett ist der Druck mit 7 ∙ 102 Pa bedeutend niedriger, d. h., die Venen stellen ein Niederdrucksystem dar. Wir werden sehen, dass diese Druckunterschiede zu einem entsprechend angepassten Wandaufbau führen.
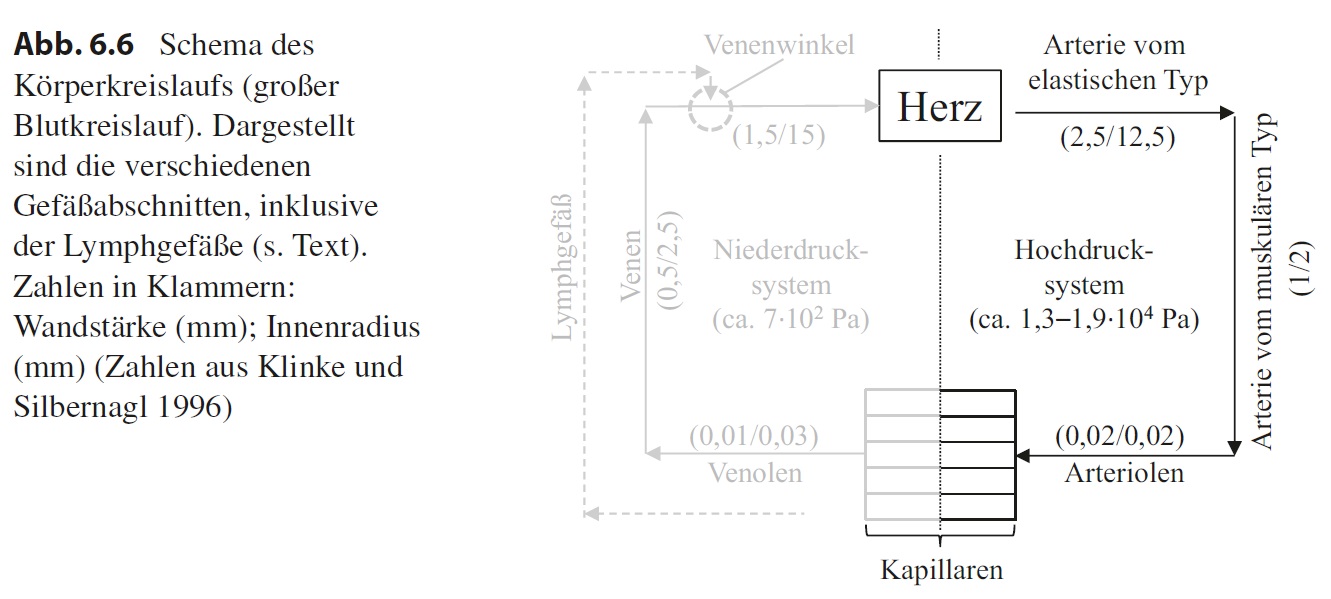
Das Gefäßsystem sorgt dafür, dass mit dem Blut Gase, Stoffwechselprodukte, Wärme und Effektormoleküle wie Hormone in kurzer Zeit über weite Strecken transportiert werden können, wobei der Austausch in den Kapillarsystemen durch Diffusion bzw. transzellulären Transport (Transcytose, Membranpumpen) stattfindet. Dabei wird auch Flüssigkeit in den extrazellulären Raum gepresst, die sich dann mit der vorhandenen Gewebeflüssigkeit mischt. Nur ein Teil dieser Flüssigkeit wird wieder von den Kapillaren aufgenommen, sodass die Menge an Gewebeflüssigkeit eigentlich ständig zunehmen müsste, bis der entstehende Druck einen weiteren Übertritt von Flüssigkeit aus den Gefäßen verhindert. Dies wird unter physiologischen Bedingungen nicht beobachtet. Der Grund ist, dass sich in den Geweben offene Gefäße befinden, die man als Lymphgefäße bezeichnet. Die Lymphgefäße nehmen als Drainagesystem überschüssige Gewebeflüssigkeit auf und speisen sie in Herznähe, im sogenannten Venenwinkel, der aus der Vena jugularis und der V. subclavia gebildet wird, wieder in den venösen Teil des Kreislaufsystems ein. Dabei vereinigen sich die immer größer werdenden Lymphgefäße, die die unteren Körperpartien drainieren, zum sogenannten Ductus thoracicus, der, zusammen mit Lymphgefäßen aus dem linken Arm und dem linken Kopfbereich, in den linken Venenwinkel mündet. Die Lymphgefäße aus dem rechten Kopfbereich, dem rechten Arm und Teilen des rechten Thorax münden dagegen in den rechten Venenwinkel. Die Lymphgefäße werden von Lymphknoten unterbrochen, durch die die Lymphflüssigkeit strömt. In der Lymphflüssigkeit können sich auch Antigene befinden, die z. B. bei Verletzungen
der einzelnen Gewebe eingedrungen sind. Solche Antigene lösen dann in den Lymphknoten eine humorale Immunantwort aus, in deren Folge antigenspezifische Antikörper gebildet werden. Weiterhin können auch Tumorzellen von einem Primärtumor aus
über die Lymphgefäße weiter im Körper verteilt werden (lymphogene Metastasierung). Die Lymphgefäße stellen wie die Venen ein Niederdrucksystem dar.

